Am 27. Juli 1921 gelang den kanadischen Medizinern Frederick Banting und Charles Best erstmals die Isolierung von Insulin aus Bauchspeicheldrüsen von Hunden. Damit eröffneten sie den Weg für die Etablierung der ersten wirklich wirksamen Behandlung von Typ-1-Diabetes. Seit der Entdeckung des Insulins versuchen Wissenschaftler seine Wirkungsweise immer detaillierter zu entschlüsseln. Dies ist wichtig, um bessere therapeutische Insuline entwickeln zu können. Vor einiger Zeit konnte eine deutsch-amerikanische Forschergruppe zeigen, wie das Hormon mit den Körperzellen interagiert.
Bindung an den Rezeptor verändert dessen Struktur
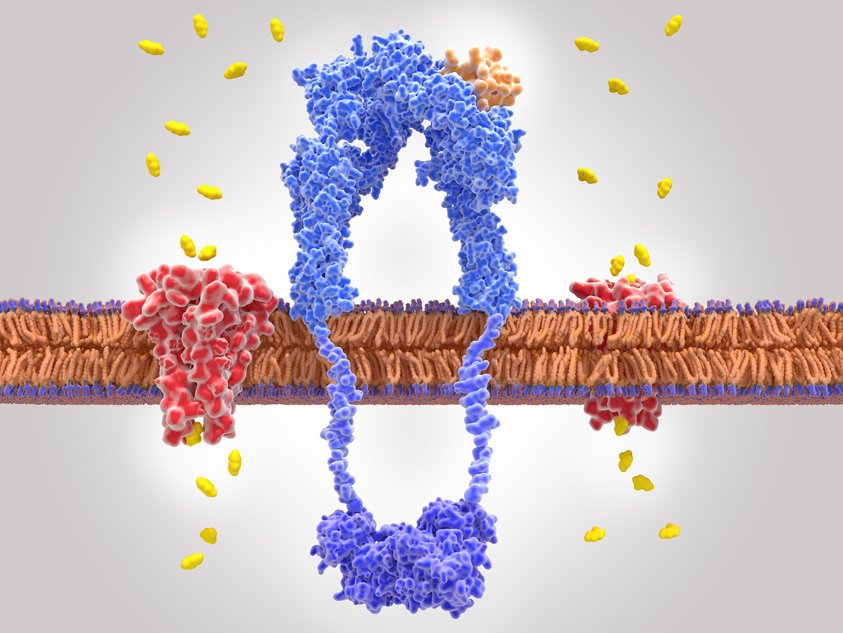
Dieser Vorgang läuft folgendermaßen ab: Insulin trifft auf Körperzellen und findet dort auf der Zelloberfläche einen speziellen Rezeptor. Bindet sich das Insulin an diesen setzt das im Zellinneren eine Kaskade in Gang, an deren Ende der Transport von Zucker aus der Nahrung in die Zellen steht.
Strukturänderung setzt Kaskade in Gang
Dieser Rezeptor für Insulin ist in der Zellmembran verankert. Ein Teil liegt im Inneren und einer außen auf der Zelle. Der Rezeptor ohne das Hormon hat außen auf der Zelle die Struktur eines „U“s. Dockt Insulin an, formt sich der Teil um und bekommt eine „T“-förmige Struktur. Durch die Strukturänderung des Rezeptors im Äußeren, verändert sich der Teil des Rezeptors, der im Inneren liegt. Dadurch nähern sich bestimmte Strukturen im Inneren der Zelle an und ein folgenreicher Signalweg nimmt seinen Lauf.
Die Forscher vermuten, dass so die Signalübertragung ausgelöst wird. „Unsere Ergebnisse zeigen direkt strukturelle Änderungen im vollständigen Rezeptor bei Insulinbindung und bieten eine Antwort auf die Frage nach dem Mechanismus, mit dem Insulin seinen Rezeptor aktiviert ”, erläutert Dr. Theresia Gutmann vom Paul-Langerhans-Institut Dresden. Dort wurde der Insulinrezeptor isoliert und aufgereinigt um die hier beschriebenen Versuche durchführen zu können.